About Gh
Gh in acquario impariamo a conoscerlo
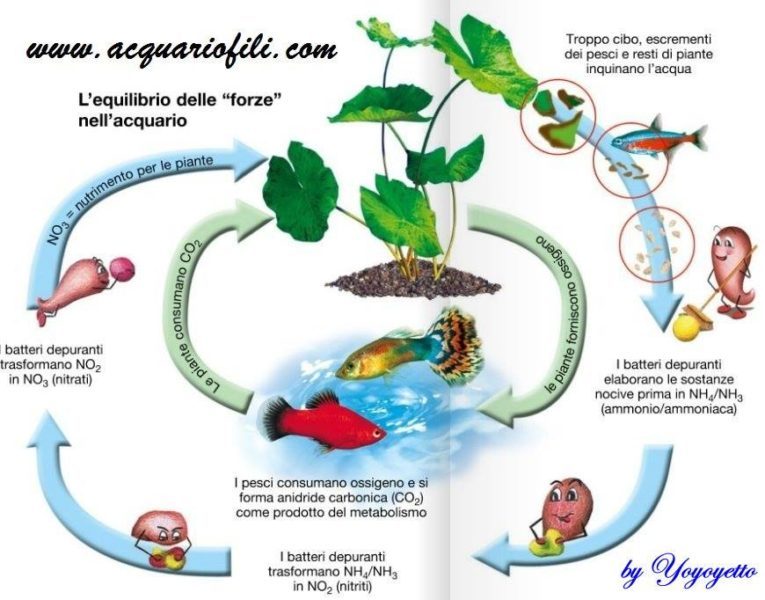
Quando si avvia un nuovo progetto o si vuole avviare un nuovo acquario, una delle prime domande che dovremmo porci è: che tipo di acqua ho a disposizione/ voglio utilizzare?

I parametri che la caratterizzano infatti sono estremamente importati per poter ottenere le condizioni ideali per la fauna e la flora stessi. Infatti, a seconda degli inquilini scelti saranno necessarie condizioni di pH, GH e KH differenti. In questo articolo approfondiremo l’argomento relativo al GH, alla sua misura e alla sua modifica.
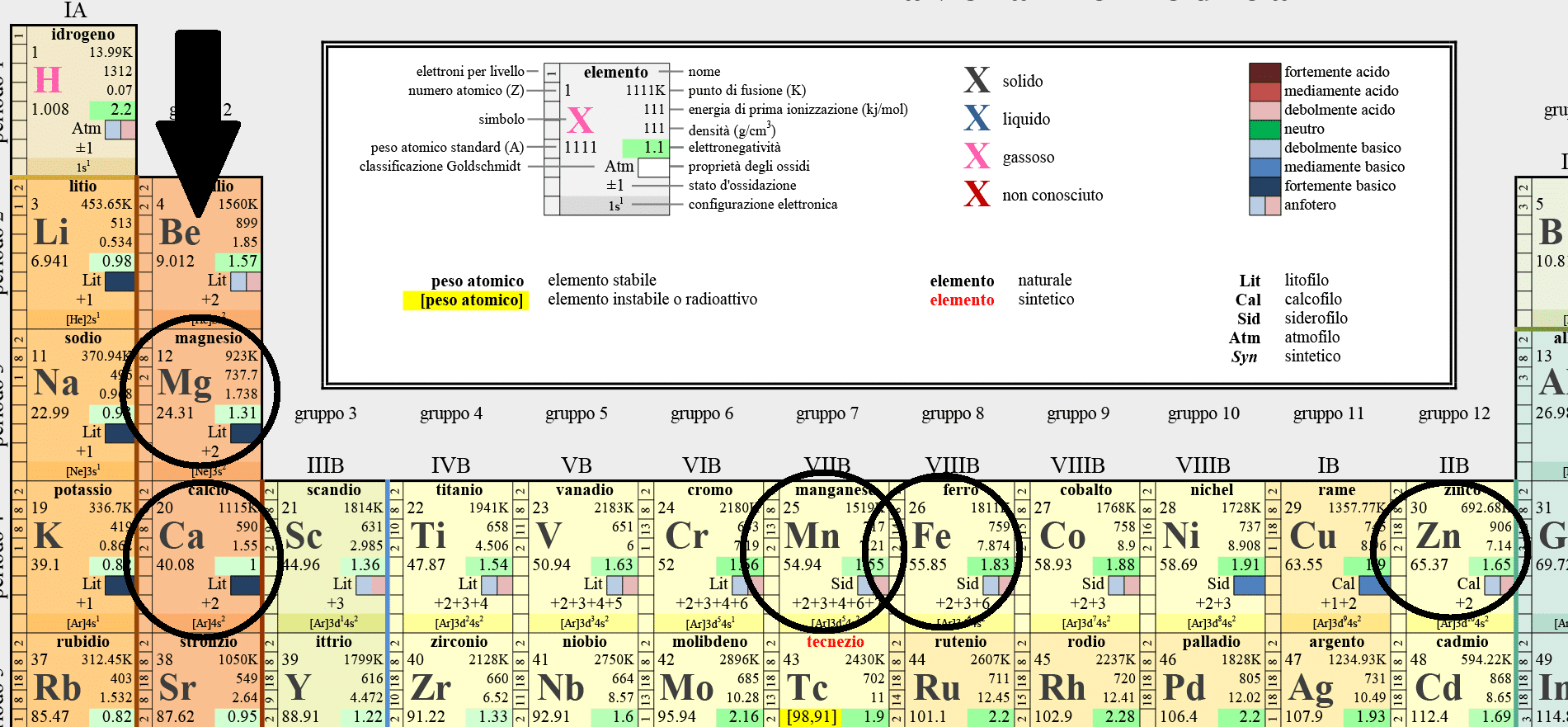
La DUREZZA TOTALE dell’acqua è un parametro che indica la quantità di cationi (ovvero ioni aventi carica positiva) di metalli alcalino-terrosi (il contributo principale è dato da Calcio, come Ca2+ e Magnesio, come Mg2+) presenti all’interno della soluzione in combinazione con anioni (ioni aventi carica negativa) di acidi forti e deboli. Questo risultato però comprende anche un piccolo contributo derivato da cationi di metalli pesanti presenti in tracce nelle nostre acque di rubinetto come Manganese (Mn), Ferro (Fe) Zinco (Zn) e altri. Focalizzandoci brevemente sul significato dell’ultima parte della definizione, ogni ione presente in soluzione deve essere accompagnato da una controparte avente carica opposta che bilanci il suo contributo (dato che la risultate in questo caso è elettricamente neutra), possiamo quindi trovare ioni come cloruri (Cl–), solfati (SO42-) e nitrati (NO3–) per la categoria acidi forti; mentre per quella degli acidi deboli troveremo i bicarbonati (HCO3–).
La durezza totale a sua volta si divide in due contributi differenti ovvero la DUREZZA PERMANENTE e la DUREZZA TEMPORANEA. La differenza va ricercata nel fatto che portando ad ebollizione l’acqua il secondo contributo viene eliminato, a causa della precipitazione dei carbonati.
Tornando al nostro acquario i parametri che possiamo e vogliamo misurare sono la durezza totale e il contributo relativo alla durezza temporanea (che però viene trattato separatamente con un articolo dedicato à qui potete trovare il link). Questi due parametri sono infatti correlati al valore del GH e del KH.
Come possiamo misurare il GH?

La determinazione di questo parametro è piuttosto semplice; basta infatti munirsi di relativo test a reagente. Esso sfrutta una reazione chimica grazie alla quale si noterà un cambiamento cromatico da rossiccio a verde scuro all’interno della provetta stessa, una volta raggiunto il valore effettivo del GH. Contando semplicemente il numero delle gocce utilizzate otterremo quindi il valore numerico del GH.
Sconsiglio l’utilizzo di test a strisce in quanto danno un valore non puntuale, ma un’indicazione sul range, che personalmente trovo poco utile.
Ma… cosa ci dice il valore che abbiamo ottenuto?
-Il valore ottenuto esprime la durezza in gradi tedeschi, ovvero:
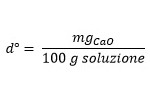 In pratica andremo a trasformare tutti i contributi alla durezza considerandoli come dovuti solo dai composti a base di Calcio, più esattamente a base di CaO.
In pratica andremo a trasformare tutti i contributi alla durezza considerandoli come dovuti solo dai composti a base di Calcio, più esattamente a base di CaO.
Questo non è l’unico modo per indicarla, infatti se leggiamo le analisi del nostro gestore dell’acqua di rete troveremo la durezza totale espressa in gradi francesi che vengono calcolati sulla base del contenuto di CaCO3:
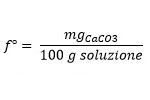 Per convertire i gradi francesi in quelli tedeschi sarà sufficiente usare la seguente formula: °d = °f x 1.78
Per convertire i gradi francesi in quelli tedeschi sarà sufficiente usare la seguente formula: °d = °f x 1.78
Nota: non è possibile ottenere un valore di durezza totale tramite il valore della conduttività, in quanto quest’ultimo viene ottenuto sommando il contributo di tutti gli ioni disciolti in acqua, non solo quelli di calcio e magnesio. Ovviamente, però, un valore elevato di GH comporterà un valore di conduttività mediamente alto. È possibile classificare le varie tipologie di acque sulla base della durezza ottenuta:
| Valore GH | Tipologia acqua |
| d°<4 | Molto dolci |
| 5<d°<8 | Dolci |
| 9<d°<12 | Mediamente dure |
| 13<d°<18 | Discretamente dure |
| 19<d°<30 | Dure |
| d°>31 | Molto dure |
Come possiamo modificare il GH?
Generalmente le nostre acque di rubinetto sono caratterizzate da una durezza medio alta, spesso inadatta per biotopi amazzonici o asiatici ad esempio. Bisogna quindi trovare un modo efficace per modificarlo.
Per ABBASSARE il GH possiamo quindi ricorrere all’uso di acqua di osmosi (RO = reverse osmosis). Essa infatti è caratterizzata da un valore di GH e KH pari a 0 (se di buona qualità) e grazie a piccoli cambi eventualmente ravvicinati, ci permetterà di ottenere il valore desiderato.
Nota: l’acqua di osmosi RO ABBASSA TUTTI i valori, non solo il GH, perché noi andiamo ad effettuare una diluizione ovvero un abbassamento della concentrazione di tutti i sali disciolti in acqua per cui successivamente dovremo operare una correzione sull’ altro parametro che caratterizza la durezza, il KH. Cliccando sul seguente link si aprirà una scheda specifica su come operare i cambi parziali e come calcolare la quantità di RO da utilizzare per ottenere un determinato abbassamento.
Per ALZARE il GH ci sono diverse strade:
- Utilizzare acqua avente GH superiore a quello della vasca durante i cambi.
- Utilizzare sali commerciali appositi (già bilanciati) in base alle proprie esigenze. Questa strada va seguita anche nel momento in cui si opta per una gestione con sola acqua di osmosi. Questa andrà ricostruita per ottenere i parametri di KH e GH desiderati (agendo singolarmente o su entrambi in contemporanea).
- Utilizzare una soluzione a base di Solfato di Magnesio (o sale inglese – MgSO4) e Cloruro di Calcio (CaCl2) avendo cura di mantenere un rapporto Ca:Mg tra 3:1 e 4:1. Nella preparazione va necessariamente usata acqua RO.
Sconsiglio l’uso del Solfato di Calcio in quanto scarsamente solubile.
Se intendete utilizzare il rimedio casalingo dell’osso di seppia, tenete presente che si avrà una variazione anche sul KH.
Nota finale: Il valore di GH è molto importante infatti un valore eccessivamente alto/basso provoca problemi ai pesci e alle piante. Infatti, gli ioni Ca2+ e Mg2+ intervengono nei processi di trasferimento nutrienti e nei prodotti di rifiuto. Può anche interferire sulla fertilità, sulla crescita e sulle funzioni renali dei pesci.
In conclusione: About Gh è una guida scritta utilizzando un linguaggio semplice in modo da essere facilmente comprensibile e quindi trasmettere concetti relativi alla chimica dellacquario,altre guide come About Gh stanno per essere emesse sul nostro portale in modo da avere un punto di riferimento per consulti piu’rapidi.
E’ vietato copiare anche parzialmente questo articolo e relative immagini senza l’autorizzazione dello staff di acquariofili e del proprietario.
About Gh impaginata da Marco Ferrara