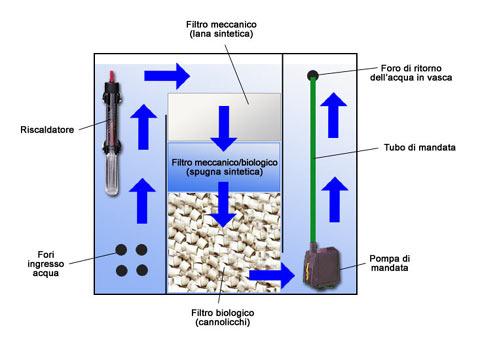
Potenziale redox :In passato si riteneva che l’ossigenazione fosse la principale necessita’ per un acquario , mentre con l’avanzare del tempo e delle conoscenze nel campo della acquariofilia, si e capito che l’importante non e ossigenare ma ossidare , infatti gli apassionati di acquariofilia hanno abbandonato l’aereatore e sono passati a mettere l’impianto co2 in modo che , fornendo alle piante il fondamentale per la loro fisiologia , permettendo l’amplificazione della fotosintesi clorofiliana , che in ultima analisi produce ossigeno ceduto direttamente nell’acqua .
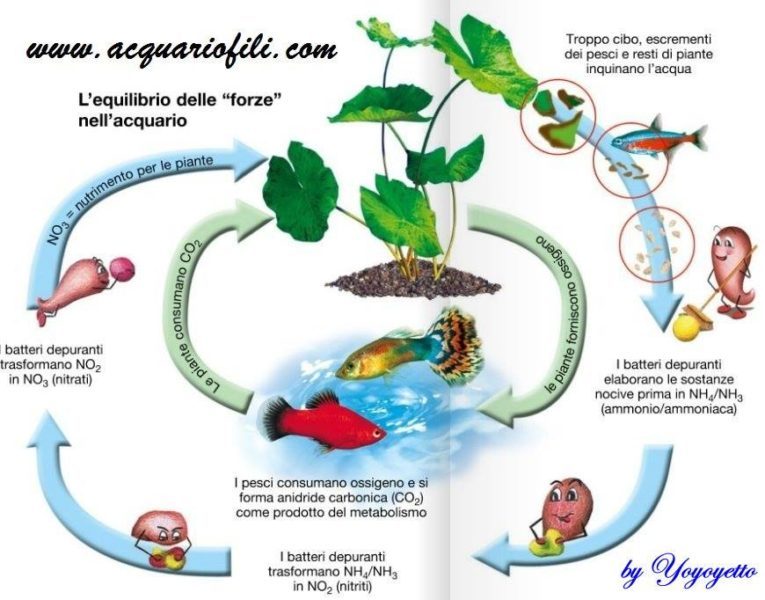
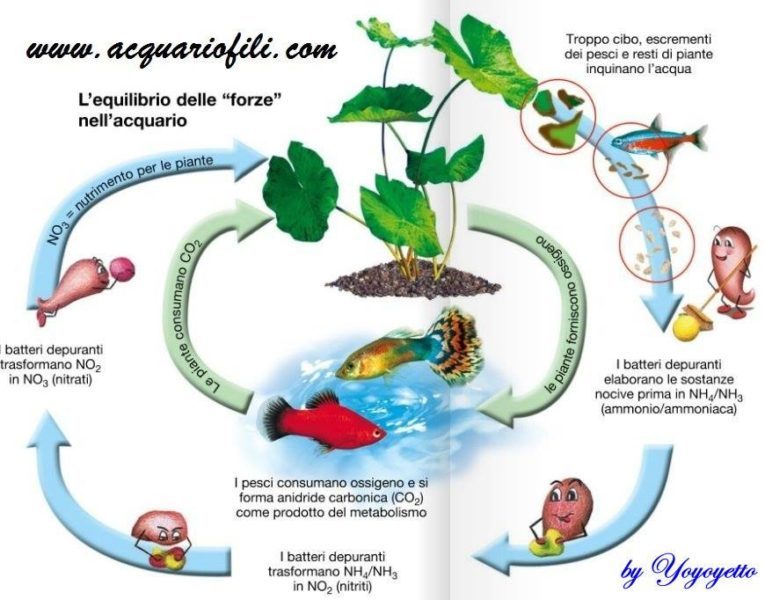
 Diversa e la questione della ossidazione che coinvolge concetti basilari di chimica e fisica , e fa veramente la differenza tra un acquario che funziona e uno malandato, quando riempiamo con acqua nuova un acquario il suo potenziale redox generalmente sara’ sui 60/90 mV , il metabolismo animale produce una serie di molecole che riducono il potenziale dell’acqua e dopo alcuni mesi potremo leggere un redox abbastanza basso prossimo a zero in queste condizioni favoriremo la vita delle piante che proliferano bene in un ambiente riducente , se la vasca contiene molti vegetali pero’ , questi producono una continua ossidazione ,dunque il potenziale redox ci dice subito quanto e equilibrato il nostro acquario,e se si mantiene stabile nel tempo ci dice subito che ha un buon equilibrio biologico, se invece tende a scendere ci dice che nel nostro acquario predomina il metabolismo animale, quindi bisogna ossidare aggiungendo piu’ piante e effetuando piu cambi parziali , se invece il redox tende a salire e segno che la vasca e stata progettata con un metodo “olandese” ed allora e necessario produrre una continua riduzione , se vogliamo che le nostre piante continuino a proliferare , diversa e la situazione nell’acquario marino dove l’ossigeno non e mai troppo e l’anidride carbonica e sempre in ecesso questo dipende dalla complessa miscela salina disciolta .
Diversa e la questione della ossidazione che coinvolge concetti basilari di chimica e fisica , e fa veramente la differenza tra un acquario che funziona e uno malandato, quando riempiamo con acqua nuova un acquario il suo potenziale redox generalmente sara’ sui 60/90 mV , il metabolismo animale produce una serie di molecole che riducono il potenziale dell’acqua e dopo alcuni mesi potremo leggere un redox abbastanza basso prossimo a zero in queste condizioni favoriremo la vita delle piante che proliferano bene in un ambiente riducente , se la vasca contiene molti vegetali pero’ , questi producono una continua ossidazione ,dunque il potenziale redox ci dice subito quanto e equilibrato il nostro acquario,e se si mantiene stabile nel tempo ci dice subito che ha un buon equilibrio biologico, se invece tende a scendere ci dice che nel nostro acquario predomina il metabolismo animale, quindi bisogna ossidare aggiungendo piu’ piante e effetuando piu cambi parziali , se invece il redox tende a salire e segno che la vasca e stata progettata con un metodo “olandese” ed allora e necessario produrre una continua riduzione , se vogliamo che le nostre piante continuino a proliferare , diversa e la situazione nell’acquario marino dove l’ossigeno non e mai troppo e l’anidride carbonica e sempre in ecesso questo dipende dalla complessa miscela salina disciolta .
Con l’aumentare della salinita’ diminuisce la quantita’ di ossigeno che possiamo disciogliere (concentrazione di saturazione) , quindi negli acquari marini tropicali, salati e caldi potremo veramente disciogliere poco ossigeno e dovremo essere certi che l’ossigeno sia sempre a saturazione,se vogliamo evitare problemi alla popolazione animale ,l’anidride carbonica invece e sempre abbondante a causa del elevata durezza dell’acqua , se la sua concentrazione diventa troppo elevata si potrebbero saturare le capacita’ tamponanti dell’acqua ed osservare piccole cadute del ph, dopo un picco di co2 in un acquario marino si registrano picchi di ph basso difficilmente risolvibili se non con cambi copiosi dell’acqua , e importante che la co2 non superi mai i livelli di guardia, e che l’ossigeno sia sempre prossimo a saturazione , questo efetto si puo facilmente ottenere con un aereatore o ad una pompa di movimento , questo spiega perche negli acquari di acqua dolce , gli aereatori e le pompe di movimento vengono usate solo in assenza di piante, perche in presenza di vegetali un distributore di co2 fornisce indirettamente molto piu’ ossigeno,se in una vasca ricca di piante e utile mantenere un redox basso, nella maggior parte degli acquari di comunita ricchi di pesci con poche piante, e utile ottenere il processo contrario , per evitare problemi con la popolazione animale. Nell’ossidazione cè la perdita di un elettrone da una molecola, atomo o ione.
Nella riduzione cè invece l’acquisizione di un elettrone da una molecola, atomo o ione.
Il valore del potenziale redox può essere considerato come indicativo dello stato di salute dell’acquario ed é influenzato dai processi batterici (un importante variazione del Potenziale Redox. è quella che si verifica in presenza di batteri, la nitrificazione: si tratta di un’ossidazione in cui l’ammoniaca viene trasformata nei dannosi nitriti e quindi negli innocui nitrati.
Una concentrazione ottimale di Ossigeno è fondamentale per ottenere un ottimo potenziale redox, la misurazione è lunga per questo i misuratori elettronici devono essere sempre immersi in vasca per una misurazione continua.
La tensione Redox si esprime in mV e ci informa sul potenziale di ossidazione o di riduzione. Si impiega un elettrodo di metallo che possiede la capacità di prendere o consegnare elettroni. Siccome lo stesso elettrodo non può reagire con l’ambiente, si devono utilizzare metalli nobili. Se nell’ambiente si trovano sostanze ossidanti o riduttive, si da un interscambio di elettroni. L’interscambio provoca a sua volta una tensione elettrica che potrà essere misurata.
A potenziali redox troppo bassi (riducenti) i pesci si indeboliscono e si scoloriscono ,il filtro biologico perde efficenza , causando il problema dell’acqua “bianca” , in pratica i batteri aerobi si muovono nella colonna d’acqua alla ricerca di condizioni di vita migliore , le piante si ricoprono di alghe e marciscono agli apici .
Quindi dobbiamo gestire un plantaquario in modo da non far scendere mai il potenziale redox al di sotto dello zero, mentre negli acquari di comunita con una ricca popolazione e poche piante dobbiamo cercare di tenerlo sopra i 50/60 mV per garantire condizioni di vita a tutti gli organismi presenti.
Nell’acquario marino gli effetti del redox sono altrettanto evidenti su pesci ed invertebrati il valore ideale in questo caso e sui 200/250 mV , in queste condizioni osserveremo invertebrati ben “aperti” e pesci ben colorati , a valori piu bassi invece i polipi di diversi invertebrati tendono a chiudersi e i pesci sono meno vispi e colorati ,e la vasca sofre della proliferazione di alcune alghe indesiderate come i cianobatteri , diatomee, ecc…. dunque e ancora piu importante in questo caso tenere un potenziale redox sempre molto elevato (ossidante), il filtro biologico necessita di ossigeno e potere ossidante per poter funzionare , infatti propio i filtri biologici che funzionano meglio , possono dare fenomeni di acqua “bianca” quando le quantita’ di ossigeno in vasca scarseggiano , o il potenziale redox e troppo basso, filtri scarsamente funzionanti non danno causa a questi fenomeni propio perche non fanno bene il loro lavoro.
E’ vietato copiare anche parzialmente questo articolo e relative immagini senza l’autorizzazione dello staff di acquariofili e del proprietario.
La guida Acidi umici e Tannini è stata impaginata da Marco Ferrara
bibliografia:
Il mio acquario
Chimica in acquario
Da marte82, Venerdi’, 8 Gennaio 2010 01:00
e impaginata da Ferrara Marco